





















-------------------------------
- Be the first to comment المحاليل 1. أساسيات حول المحاليل م . د . اياد أبو ربيع 2. المحلول
مزيج متجانس مؤلف من اكثر من مركب
المذيب أو المحل
المذاب أو المادة المنحلة
عدد جزيئات المذيب أو المحل هي أكبر من عدد جزيئات المذاب أو المادة المنحلة
3. الكسر الجزئي
هو حاصل قسمة عدد جزيئات المادة المنحلة على عدد جزيئات المحلول ( مادة منحلة + مادة حالة )
n1/n1+n2
n1 عدد جزيئات المادة المنحلة
n2 عدد جزيئات المادة الحالة
4. التركيز الوزني
هو النسبة بين كتلة المادة المنحلة وحجم المادة الحالة
C=m/v
C التركيز الوزني
m كتلة المادة المنحلة
V حجم المادة الحالة
وتقدر بال غ / ل أو بال مغ / مل
5. التركيز الجزيئي
هو عدد جزيئات المادة المنحلة في واحدة حجم المحلول
m r =n/v
m r التركيز الجزيئي
n عدد جزيئات المادة المنحلة
v حجم المادة الحالة
وتقدر بالجزيئة / ليتر
6. التركيز الجزيئي الغرامي
هو عدد جزيئات المادة المنحلة في واحدة كتلة المحلول
m r =n/m
m r التركيز الجزيئي الغرامي
n عدد جزيئات المادة المنحلة
v كتلة المادة الحالة
وتقدر بالجزيئة / كيلوغرام
7. تصنيف المحاليل كهربائياً
محاليل حيادية : جسيمات المنحل معتدلة كهربائياًَ والمنحل على شكل جزيئات
محاليل شاردية جسيمات المنحل مشحونة كهربائياً أي المنحل على شكل شوارد
8. تصنيف المحاليل بحسب حجم الجزيئات المنحلة
محاليل حقيقية حيث جزيئات المنحل دقيقة
محاليل كاذبة غروية حيث جزيئات المنحل ضخمة
9. المحاليل الكاذبة الغروية
تتكون من اتحاد مكونين أحدهما وسط سائل مائي أو شحمي والثاني جزيئات معلقة غير منحلة وذات طبيعة مختلفة عن الوسط ( الدم )
لها ثلاثة أصناف
الحلالات عدد الجزيئات المبعثرة قليل
الجيلاتينات تتوضع الجزيئات المعلقة بشكل غير منتظم
المعاجين ذات لزوجة أعلى من الجيلاتينات تكون جسيماتها منتظمة التوضع
10. استقرار المحاليل الكاذبة الغروية
يمكن رفع ثبات المحاليل الغروية باضافة معقدات متعددة السكريات ( الألجينات ) الى الجسيمات مما يرفع درجة الاماهة لديها ( يتغلف الجسيم بطبقة من الماء المحيط )
يمكن انقاص ثبات المحلول الغروي
بتبديل نوع الجسيمات أو طبيعتها
بتبديل الوسط ( اضافة الكحول )
11. ظاهرة الانتشار
ظاهرة فيزيائية تميل فيها الأوساط غير المتجانسة لتصبح متجانسة
قانون فيك
dm كمية المادة المنتشرة عبر مقطع انبوبي
S مساحة المقطع
dx المسافة بين النقطتين
dc اختلاف التركيز بين النقطتين
DS معامل الانتشار
فسر الاشارة السالبة
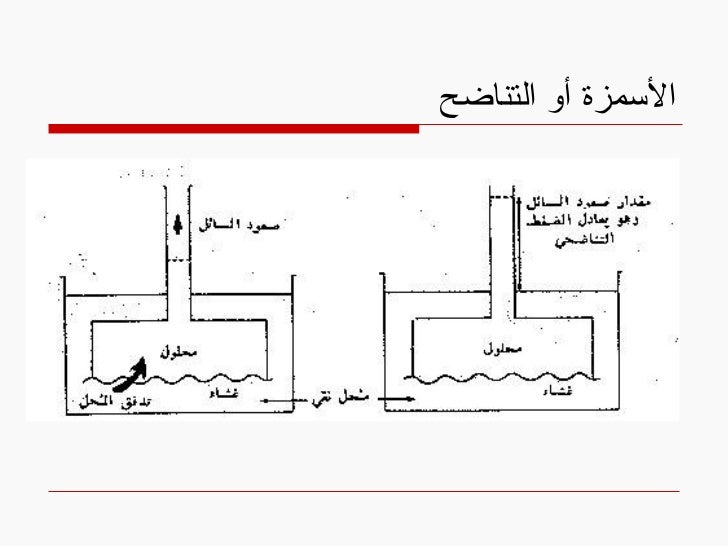
12. الأسمزة أو التناضح
لنفرض محلولين بتركيز مختلف على جانبي غشاء نفوذ للمحل فقط
حسب قانون فيك لاتستطيع المادة المنحلة التحرك من التركيز العالي للتركيز المنخفض
بدلاً من ذلك تحدث هجرة للمحل عكس هذا الاتجاه ( من التركيز المنخفض باتجاه التركيز العالي )
تسمى هذه الظاهرة بقانون التناضح أو الضغط الحلولي
13. الأسمزة أو التناضح 14. المحاليل الأيونية
هي محاليل ناقلة للتيار الكهربائي بانتقال الشوارد الموجبة والسالبة
تتشرد فيه الجزيئات المنحلة الى شوارد موجبة وشوارد سالبة
الشاردة هي ذرة أو جزئ
فقد الكترونا أو أكثر ( شاردة موجبة H + , Ca ++ )
أو كسب الكتروناً أو أكثر ( شاردة سالبة OH - , O -- )
15. شاردة الهيدروجين
يتحلل الماء كهربائياً بشكل ضعيف
باعتبار K هي ثابت التشرد للماء
يكون ثابت التأين صغيراً يمكن اذا عد فعالية الماء غير المتشرد ثابتة
16. شاردة الهيدروجين
في درجة حرارة الغرفة (23 ) يكون
10 -14 = K H2O
اذاً
[H + ]=[OH - ]=10 -7
17. تعريف ال pH
لا يمكن قياس تركيز شاردة الهيدروجين بالتركيز الوزني ولا بالتركيز الجزيئي لسببين
تركيز شاردة الهيدروجين في المتعضية ضعيف جداً
يتبدل هذا التركيز بدرجات كبيرة جداً
لهذا يتم اللجوء الى قياس اللوغاريتم العشري متبدل الاشارة لتركيز ايون الهيدروجين
[H + ]=10 -7 pH= 7
18. تعريف ال pH
[H + ]=10 -7 pH= 7
كلما ازداد تركيز ايونات الهيدروجين تنخفض قيمة الباهاء وتزداد حموضة الوسط
كلما نقص تركيز ايونات الهيدروجين تزداد قيمة الباهاء وتزداد قلوية الوسط
19. المركبات الأيونية القوية والضعيفة
المركبات الأيونية القوية تتشرد في الماء بشكل تام
المركبات الأيونية الضعيفة تتشرد بشكل جزئي لتعطي
قسم غير متشرد
شوارد
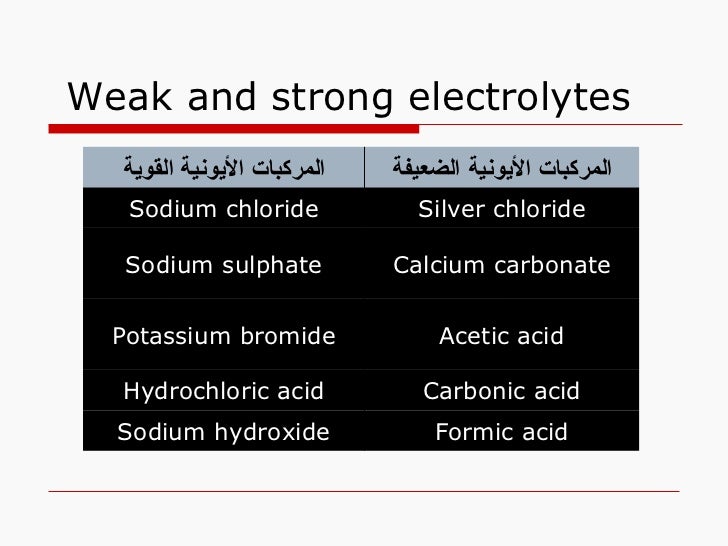
20. Weak and strong electrolytes Formic acid Sodium hydroxide Carbonic acid Hydrochloric acid Acetic acid Potassium bromide Calcium carbonate Sodium sulphate Silver chloride Sodium chloride المركبات الأيونية الضعيفة المركبات الأيونية القوية 21. الحموض الضعيفة
عندما يتشرد حمض ضعيف (HA) بشكل جزئي يعطي شوارد هيدروجين موجبة (H+) وشوارد سالبة (A-)
ان قياس تركيز شوارد الهيدروجين بهذه الحالة لايعطي صورة حقيقية عن تركيز شوارد الهيدروجين الكلي لأن بعض من الهيدروجين يبقى في القسم غير المتشرد
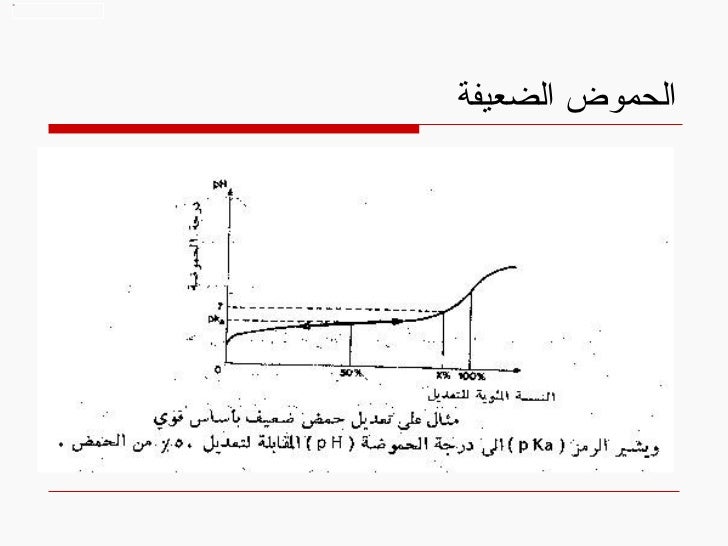
22. الحموض الضعيفة
عند تعديل الحمض الضعيف بأساس قوي يبدأ القسم غير المتشرد بالتشرد ونصل لتركيز شوارد الهيدروجين الحقيقية
بهذه الحالة لاتعكس الباهاء حموضة الوسط قبل التعديل ( أي يختلف تركيزشوارد الهيدروجين قبل وبعد التعديل )
طبعاً في الحموض القوية لا يختلف تركيزشوارد الهيدروجين قبل وبعد التعديل
23. الحموض الضعيفة
يتشرد الحمض الضعيف (HA) بشكل عكوس في الماء
يحدد الثابت (k) العلاقة بين تركيز الشوارد والقسم غير المتشرد من الحمض
24. الحموض الضعيفة
عند اعادة ترتيب المعادلة لعزل قيمة شوارد الهيدروجين
نحسب اللوغاريتم العشري لطرفي المعادلة
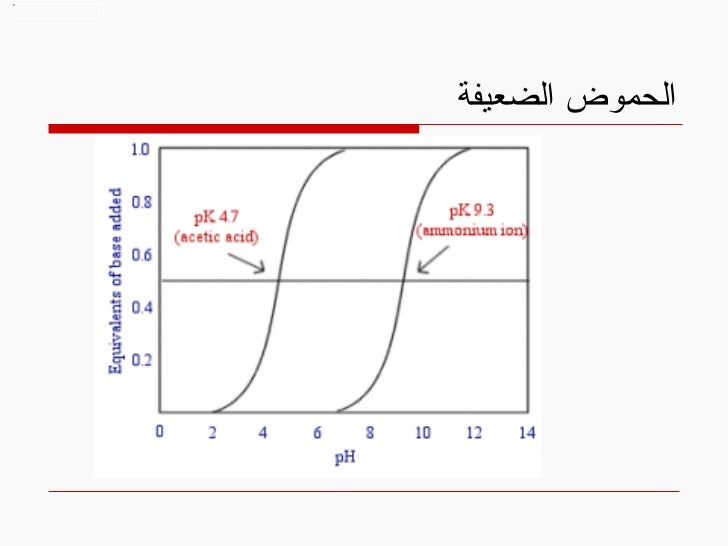
25. الحموض الضعيفة
نضرب الطرفين ب -1
نستبدل pH بدلاً من -log[H] و pK بدلاً من – logK
26. الحموض الضعيفة
معادلة Henderson-Hasselbalch
عندما يتعدل نصف الحمض اذاً
log [salt]/[acid] = 0
27. الحموض الضعيفة 28. الحموض الضعيفة 29. تطبيقات على ال pH : المخدر الموضعي في طب الأسنان
المخدرات الموضعية عبارة عن أسس ضعيفة
Pka = 8-9
تتواجد في الجسم وفي موقع الحقن بشكليها المتشرد وغير المتشرد
الشكل غير المتشرد ينتشر في النسج بسرعة أكبر من الشكل المتشرد
الشكل المتشرد أكثر الفة مع المستقبلات النوعية
30. تطبيقات على ال pH : المخدر الموضعي في طب الأسنان
تتأثر فعالية التخدير الموضعي بباهاء pH مكان التخدير
عندما ترتفع ياهاء مكان الحقن تكون المادة الفعالة غير متشردة فتخترق النسج بسهولة ولكن لاترتبط بسرعة الى مستقبلات الغشاء الخلوي للعصبون
عندما تنخفض ياهاء مكان الحقن تكون المادة الفعالة متشردة فتخترق العصب بصعوية ولكن ترتبط بسرعة الى مستقبلات الغشاء الخلوي للعصبون وتخف فعالية المخدر لعدم قدرته على اختراق الغشاء العصبي
31. تطبيقات على ال pH : المخدر الموضعي في طب الأسنان
عند حقن المخدر الموضعي
تتفاعل مع البيكربونات لتتحرر كمية من الشكل غير المتشرد بنسبة 30%
فقط القسم غير المتشرد يدخل العصب
يتشرد بأكمله في العصب بتأثير ال pH داخل العصب
هذا القسم المتشرد هو المسؤؤل عن فعل التخدير
32. تطبيقات على ال pH : المخدر الموضعي في طب الأسنان
عند وجود التهاب موضعي انتاني
ترتفع بشكل واضح حموضة الوسط موضعياً
يتشرد القسم الأعظم من المخدر الموضعي
لا يستطيع المخدر اذاً اختراق الغشاء السيتوبلاسمي للعصبون
تخف أو تنعدم فعالية المخدر
Recommended -
---------------
ليست هناك تعليقات:
إرسال تعليق