-------
-----

























































57 of 58
مذكرة مميزة فى كيمياء 1ث
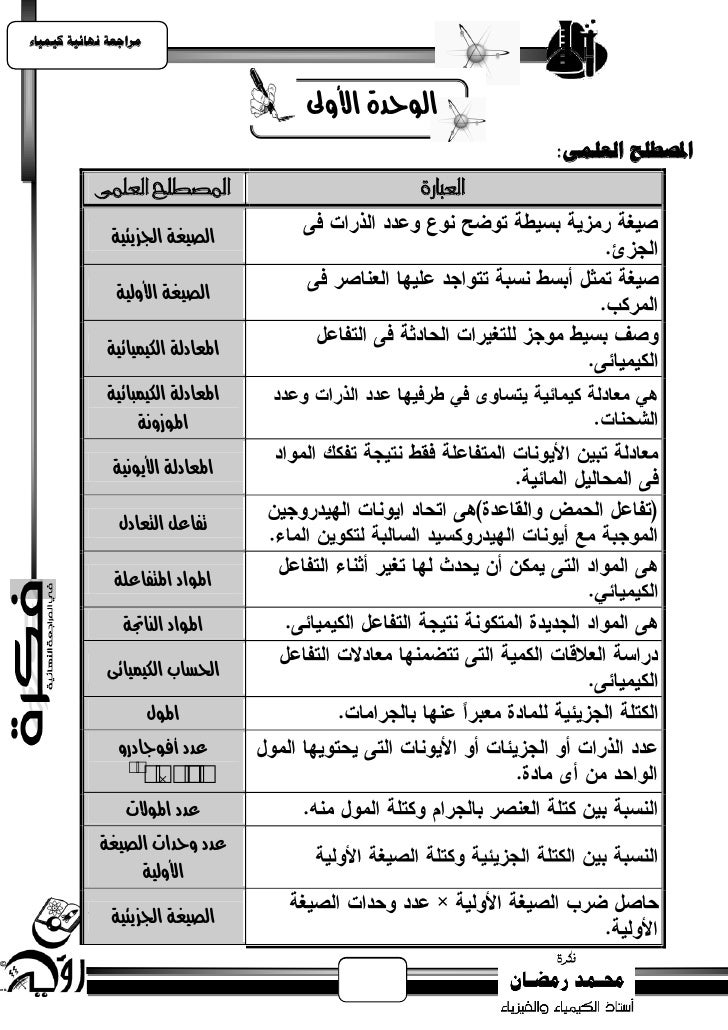
1. يساجعت نهبئيت كيًيبء الوحدة األوىل املصطهح انعهًً: املصطلح العلنى العبارة الصيغة اجلشيئية الصيغة األولية املعادلة اللينيائية املعادلة اللينبائية املوسوىة املعادلة األيوىية تفاعل التعادل املواد املتفاعلة املواد الياجتة احلضاب اللينيائى املول عدد أفودادرو 2 3 2 6 ×1 0. 0 عدد املوالت عدد وحدات الصيغة األولية الصيغة اجلشيئية
2. يساجعت نهبئيت كيًيبء املصطلح العلنى العبارة تفاعالت الرتصيب العوامل احلفاسة عهم ملب يأتً:
3. يساجعت نهبئيت كيًيبء 1] حضاب الصيغة األولية [ ]21 = [H = 1 , C انحم:- C H 4CH 2] حضاب الصيغة اجلشيئية [ اىنخيت اىجزيئيت عدد وحداث اىصيغت األوىيت = مخيت اىصيغت األوىيت 2CH انحم1:- 2CH
4. يساجعت نهبئيت كيًيبء 8C4H 2CH 3] حضاب املول[ ]1 = [O = 16 , H انحم1:- ][H2O ]61 = [S = 32 , O )2(SO انحم2:- )2(SO
5. يساجعت نهبئيت كيًيبء ]32 = [Na )3(Na2CO )702 = (Pb [4] احلضاب اللينيائى )2H2(g) + O2(g )2H2O(g ]61 = [H = 1 , O انحم1:- )2H2(g) + O2(g )2H2O(g ][H2O ]61 = [Mg = 24 , O انحم2:- )(Mg )(MgO
6. يساجعت نهبئيت كيًيبء 2Mg + O2 2MgO CaCO3 CaO + CO2 [Ca = 40, C = 12, O = 16] :3انحم (CaCO3) (CaO) CaCO3 CaO + CO2 [Na = 23, Cl = 35.5] (NaCl) -:4انحم NaCl NaCl Na+ + Cl-
7. يساجعت نهبئيت كيًيبء )-(Cl = [Zn ]5.53 = 65, Cl انحم5: )2(ZnCl Zn + 2HCl 2ZnCl2 + H يسبئم عهً انىحدة األوىل ]21 = [H = 1 , C ]61 = [Na = 23, C = 12, O 2CH ]1 = [C = 12, H ]61 = [N = 14, O ]1 = [N = 14, H 2CH ]1 = [C = 12, H
8. يساجعت نهبئيت كيًيبء [Mg = 24, S = 32, O = 16, H = 1] [Zn = 65, S = 32, O = 16, H = 1] 2H2(g) + O2(g) 2H2O(g) [S = 32 , O = 16] (SO2) [Na = 23] (Na2CO3) [Na = 23, C = 12, O =16] (Pb = 207) [Mg = 24, H = 1, Cl = 35.5] CH4 + 2O2 CO2 + 2H2O [C = 12, H = 1, O = 16] 2H2 + O2 2H2O وضح ببملعبدالث انسيصيت املىشونت
9. يساجعت نهبئيت كيًيبء الوحدة الجاىية املفهىو انعهًي : املفهوو العبارة العلنى احمللول احلقيقى املذيب املذاب املعلق الغزوى األمحاض +H القواعد -OH القلويات +H تفاعل التعادل -OH الزابطة اهليدرودييية األمحاض القوية األمحاض الطعيفة امللح Na2CO3.10H2O صودا الغضيل
10. يساجعت نهبئيت كيًيبء املفهوو العبارة العلنى ,4{H2SO األمحاض }HCI املعدىية األمحاض }{CH3COOH العطوية قاعدية احلنض أىَيدريد القاعدة التأيً البيشيً العطزى عنلية التصنب التنيع اللاتيوٌ األىيوٌ اذكس انسبب انعهًً
11. يساجعت نهبئيت كيًيبء CH3COOH (H+) (OH-) NH3 NH4Cl + NaOH NaCl+H2O+NH3
12. يساجعت نهبئيت كيًيبء CO2 + Ca(OH)2 CaCO3 + H2O
13. يساجعت نهبئيت كيًيبء
14. يساجعت نهبئيت كيًيبء املقبزنبث احمللول الغروى احمللول احلقيقى
15. يساجعت نهبئيت كيًيبء تصييف األمحاض 1] تقسيه األمحاض طبقاً لطبيعة ميشأها:- [ أمحاض عضوية أمحاض معدىية املقارىة ميشأها HCl CH3COOH 3HNO أمجلة 6C4H6O 4H2SO 7C6H8O 2] تقسيه األمحاض تبعاً لقوتها:-[ أمحاض ضعيفة أمحاض قوية املقارىة التأيً التوصيل للكهرباء CH3COOH HCl 3HNO أمجلة 3C3H6O 4H2SO
16. يساجعت نهبئيت كيًيبء 3] تقسيه األمحاض تبعاً لعدد قاعديتها:-[ أمحاض ثالثية أمحاض ثيائية أمحاض أحادية املقارىة القاعدية القاعدة القاعدة عدد الربوتوىات )+(H HCl 4H3PO 4H2SO أمجلة CH3COOH 7C6H8O 4H2C2O 3HNO
17. يساجعت نهبئيت كيًيبء اللشف عً بعض الشقوق احلامطية: بتفاعل محض اهليدروكلوريك مع أمالح األمحاض األقل ثباتاً: (الشق احلامضى) املشاهدة التجربة )-23(CO )2(CO )-3(HCO )2(SO )-23(SO )2(SO -2)3(S2O )(S )(NO - )2(NO )2(NO التنييز بني ملح الكربوىات والبيكربوىات: (الشق احلنضى) املشاهدة التجربة )-23(CO )-3(HCO
18. يساجعت نهبئيت كيًيبء مب دور مو مه بىدرة اىخيل فى صىبعت اىصببىن:
19. يساجعت نهبئيت كيًيبء اكًم انعببزاث اآلتيت 3SO )(II
20. يساجعت نهبئيت كيًيبء .dil 4(24) Zn + H2SO ……+ …… .dil 4(25) CuO + H2SO …… + …… .dil )62( Mg + 2HCl …… + …… )72( 3KOH + HNO …… + …… )82( 3ZnCO3 + 2HNO …… + …… )92( 2MgSO4 + BaCl …… + …… )03( 4CuCO3 + H2SO …… + …… )13( NH4Cl + NaOH …… + …… اكتب املعبدالث انىت تدل عهً انتفبعالث اآلتيت اخرت ين بني األقىاض C 2CO
21. يساجعت نهبئيت كيًيبء 4H2C2O 4H3PO 3C6H8O7 C3H6O 3(C3H6O 6C4H6O )CH3COOH 7C6H8O 4H2SO 4H2C2O أكتب املصطهح انعهًً انري تدل عهيه انعببزاث اآلتيت:-
22. يساجعت نهبئيت كيًيبء عهم ملب يأتً: 4H3PO كيف تفسق بني:- وضح ثبنشسى
23. يساجعت نهبئيت كيًيبء الوحدة الجالجة املفهىو انعهًي : املفهوو العبارة العلنى اليظائز امليشوٌ اإلللرتوٌ فولت طاقة الرتابط اليووى اليشاط اإلشعاعى الطبيعى التفاعل اإلىشطارى التفاعل املتضلضل عنز اليصف دضيه ألفا دضيه بيتا التفاعل
24. يساجعت نهبئيت كيًيبء املفهوو العبارة العلنى االىدمادى ىظزية الله لبالىم قاىوٌ بالىم التفاعالت التووية مجمىع أعداد اىبروحىوبث اىمىجبت أو األىنخرووبث اىخى حدور حىه العدد الذرى اىىىاي فى اىحبىت اىعبديت العدد اللتلى الوسٌ الذرى تظزية الدكتور على مشزفة ثابت بالتم وحدة اللتل الذرية الضعز اجلول
25. يساجعت نهبئيت كيًيبء املفهوو العبارة العلنى العيصز املضتقز العيصز املشع اللتلة احلزدة اليشاط األشعاعى الصياعى
26. يساجعت نهبئيت كيًيبء اذكس انسبب انعهًً :
27. يساجعت نهبئيت كيًيبء . (11) 92U 832 1+ 0n 92U 932 + 932 932 92U 93Np 0+ -1e 932 932 93Np 94Pu 0+ -1e
28. يساجعت نهبئيت كيًيبء أهى انسسىيـــــــــبث : T.N.T
29. يساجعت نهبئيت كيًيبء يسبئم
30. يساجعت نهبئيت كيًيبء 91 9F 65 26Fe
31. يساجعت نهبئيت كيًيبء الوحدة الزابعة املصطهح انعهًي املصطلح العبارة العلني اللينياء احلزارية طاقة وضع اإلللرتوٌ طاقة حزكة اإلللرتوٌ اجلشئ طاقة الزابطة التفاعل اللينيائى حملول ربع مولز اجلول 1 81.4 حزارة الذوباٌ صعزال احملتوى احلزارى قاىوٌ ٍط طاقة اإلماٍُ احمللول املوالرى قوى دذب فاىدرفال الشبلة البلورية
32. يساجعت نهبئيت كيًيبء املصطلح العبارة العلني أكضيد ىيرتيم حزارة التخفيف حزارة الذوباٌ حزارة الذوباٌ املوالرية التغري فى احملتوى احلزارى احلالة القياصية املعادلة اللينيائية احلزارية غاس األوسوٌ ثاىى أكضيد الييرتودني طاقة الشبلة البلورية حزارة الرتصيب حزارة التلويً ة احلالة الفيشيائي الرتكيش باملولز طاقة املضتوى Hلتفاعل كينيائى
33. يساجعت نهبئيت كيًيبء املصطلح العبارة العلني تفاعل ماص للحزارة طاقة اإلماٍة طاقة االرتباط عهم ملب يأتً
34. يساجعت نهبئيت كيًيبء H2O H2O -* HI HF HF > HCl > HBr > HI H
35. يساجعت نهبئيت كيًيبء H
36. يساجعت نهبئيت كيًيبء يبذا يقصد بـ 5.53 = H = 1, Cl (6) طبقت اىرابطت فى جزئ اىبروً = 64 ك. سعر/مىه. (7) اىطبقت اىمىطيقت عىد حنىيه مىه مه 2 COمه عىبصري األوىيت فى حبىخهب اىقيبسيت 393 ك.ج 2CO (8) طبقت اىشبنت اىبيىريت فى ميح اىطعبً = 5.12 ك. جىه / مىه NaCl
37. يساجعت نهبئيت كيًيبء يقبزنبث H H
38. يساجعت نهبئيت كيًيبء التحويل مً دول إىل صعز انطبقخ ثبنجىل انطبقخ ثبنسعش 81.4 = التحويل مً صعز إىل دول انطبقخ ثبنجىل = انطبقخ ثبنسعش × 81.4 الرتكيش املوالرى عذد انًىالد يٍ انًبدح انًزاثخ انزشكيض انًىالسي انحجى ثبنهزش = وصٌ انًزاة ثبنجشاو انزشكيض = انكزهخ انجضيئيخ انجشاييخ نهًزاة × حجى انًحهىل ثبنهزش وصٌ انًبدح ثبنجشاو عذد انًىالد = انكزهخ انجضيئيخ انجشاييخ التغري فى احملتوى احلزارى H =H انًجًىع انججشي نطبقخ ركىيٍ انشواثط وطبقخ كسش انشواثط كنية احلزارة كًيخ انحشاسح = كزهخ انًبدح × حشاسرهب انُىعيخ × فشق دسجبد انحشاسح حشاسح انزوثبٌ = انًجًىع انججشي نطبقخ اإليبهه وطبقخ انشجكخ انجهىسيخ حشاسح انزخفيف = رغيش انحشاسي نهًحهىل انثبًَ – انزغيش انحشاسي نهًحهىل األول ال التغري فى احملتوى احلزارى H انزغيش انحشاسي =H حشاسح ركىيٍ انُىارج – حشاسح ركىيٍ انًزفبعالد
39. يساجعت نهبئيت كيًيبء مسائل ]61 = [H = 1, S = 32, O 4H2SO وصٌ انًزاة ثبنجشاو انكزهخ انجضيئيخ انجشاييخ نهًزاة × حجى انزشكيض = انًحهىل ثبنهزش H 2N2 + 3H 32NH .N N = 946 K. J., N – H = 390 K. J., H – H = 435 K.J اىحو H | N N + 3H – H 2 N–H | H طبقخ كسش انشاثطخ طبقخ ركىيٍ انشاثطخ H H 2CI2 + 2H2O 24HCl + O
40. يساجعت نهبئيت كيًيبء H – Cl = 432 KJ, Cl – Cl = 242 KJ, O = O = 497 KJ, O – H = 463 KJ Cl Cl CH4 + Cl2 CH3Cl + HCl, Δ H = - 25 K.cal H - Cl CH3 - Cl CH3 - H 2C2H6 + 7O2 4CO2 + 6H2O, H = - 2400 K.J. – :اىحو حشاسح ركىيٍ انًزفبعالد حشاسح ركىيٍ انُىارج – – H – CH4 (g) + 2O2(g) CO2 (g) + 2H2O(v) :اىحو – H
41. يساجعت نهبئيت كيًيبء حشاسح ركىيٍ انًزفبعالد حشاسح ركىيٍ انُىارج – H Al2Cl6 + 6 Na .2Al + 6 NaCl, H = - 1074.6 K.J اىحو Al2Cl6 + 6 Na .2Al + 6 NaCl, H = - 1074.6 K.J حشاسح ركىيٍ انًزفبعالد حشاسح ركىيٍ انُىارج – H – ]1 = [S = 32, O = 16, H اىحو ]4[H2SO
42. يساجعت نهبئيت كيًيبء ]32 = [H = 1, O = 16, Na اىحو:- ][NaOH )(KOH )93 = (H = 1, O = 16, K )Ag+NO3-(aq) + Na+Cl-(aq )Na+NO3-(aq) + AgCl(s H = -35.6 kJ/mol (أ) رشسيت 1.0 يىل يٍ كهىسيذ انفضخ. (ة) رشسيت 53.41 جى يٍ كهىسيذ انفضخ. إرا عهًذ أٌ انكزم انزسيخ كبآلرً: }801 = {Cl = 35.5, Ag اىحو ][AgCl
43. يساجعت نهبئيت كيًيبء اىحو:- HCl اىحو:- يسبئم غري حمهىنت
44. يساجعت نهبئيت كيًيبء C + O2 CO2, H = - 393.3 KJ CO + ½ O2 CO2, H = - 283.7 KJ N2O2, NO, NO2 N2 + 3H2 2NH3, Δ H = - 89 K.J. H H N H ΔH H2 + Br2 2HBr H H Br Br H - Br [H2SO4] [H = 1, S = 32, O = 16] Cl Cl CH4 + Cl2 CH3Cl + HCl, Δ H = - 25 K.cal CH3 - H CH3 - Cl H - Cl N2 + O2 2NO, Δ H = + 180 K.J.
45. يساجعت نهبئيت كيًيبء C + O2 CO2, Δ H = - 393.5 K.J. 1 N2 + 3 H2 NH3, H = - 46.19 K J 2 2 2C + 2H2 C2H4, H = +52.3 K.J. [Na = 23, H = 1, O = 16] [Na = 23, H = 1, O = 16] C3H8 C3H8 + 5 O2 3CO2 + 4H2O Δ H - 2228.5 K.J. 2C2H6 + 7O2 4CO2 + 6H2O Δ H - 2400 K.J.
46. يساجعت نهبئيت كيًيبء 22H2 + O .2H2O Δ H - 570 K.J 2C2H2 + 5/2 O 2CO2 + H2O
47. يساجعت نهبئيت كيًيبء الوحدة اخلامضة املصطهح انعهًً املصطلح العلني العبارة التخنز الالٍوائى (البيوداس) (امليجاٌ) ( غاس املضتيقعات) اهليدروكزبوىات البلنزة التقطري التذشيئى إعادة الدورة تلوخ البيئة الغاس املائي أثز البيت األخطز (الصوبات الشدادية) التلضري رابع إيجيل الزصاص أللاىات غاس اإليجيلني التقطري اإلتالفى غاس البوتاداس األللييات
48. يساجعت نهبئيت كيًيبء املصطلح العلني العبارة األللاييات البولينز احرتاق الوقود رقه األوكتاٌ رقه األوكتاٌ التيقية البيشوبرييً أكضيد ىيرتيم الوقود حزارة الذوباٌ غاس األوسوٌ ثاىى أكضيد الييرتودني 2CO طاقة املضتوى أول أكضيد اللزبوٌ الفزض العطوى الفصل التحويل التخنز اللحوىل إىشيه اإلىفزتاس
49. يساجعت نهبئيت كيًيبء املصطلح العلني العبارة إىشيه الشمياس 2CO امللوثات محض اخلليلم عهم ملب يأتً 2H2 + Cl 2HCl + heat, light 43 - 2CO
50. يساجعت نهبئيت كيًيبء
51. يساجعت نهبئيت كيًيبء
52. يساجعت نهبئيت كيًيبء أسئهت يتنىعت أضزار مزكبات الزصاص. ( 1) (2) مادة البيشوبرييً. (3) غاس أول أكضيد اللزبوٌ: (4) أثز البيت األخطز لغاس ثاىى أكضيد اللزبوٌ: 2CO 2CO
53. يساجعت نهبئيت كيًيبء املقبزنبث . . )02(C )21(C ) ( )01(C5:C
54. يساجعت نهبئيت كيًيبء وضح اندوز انري يقىو به كم ين: 1] البلرتيا فى صياعة البيوداس: [ 2] رابع أيجيل الزصاص 4)5 Pb(C2Hعيد إضافتُ للذاسولني: [ 3] أىشيه األىفزتاس أثياء التخنز اللحوىل:[ 4] األصطح الشدادية وتلويً غاس ثالح أكضيد اللربيت: [ 5] أكضيد امليذييش أو أكضيد األلومييوو أو الطفل فى التلضري احلفشى:[ 6] أىشيه الشمياس أثياء التخنز اللحوىل:[ يب املقصىد بكم ين: 1] رقه أوكتاٌ لوقود 9 0 [ 2] غاس البوتاداس: [ 3] الفزض العطوى ليشأة البرتول:[ انذالئم عهً صحخ انفشض انعضىي:
55. يساجعت نهبئيت كيًيبء وضح ببملعبدالث انسيصيت انفرتاز 4C2H5OHزيماز C12H22O11 + H2O 6C6H12O6 + C6H12O 2+ 4CO C2H5OH CH3COOH + H2O 2H2 + Cl 2HCl + heat, light Heat 2S + O 2SO Cat./ H 22SO2 + O 32SO SO3 + H2O 4H2SO أضرار أمبسيد اىنبريج: أضرار األمطبر اىحبمضيت ىحمض اىنبريخيل 3CaCO 4CaSO cat./H CH4 + H2O 2CO + 3H
56. يساجعت نهبئيت كيًيبء cat./H 2CO + 2H CH3OH 2NO2 + H2O 2HNO3 + HNO أضشاس أكبسيذ انُيزشوجيٍ: 22NO + O 22NO
57. يساجعت نهبئيت كيًيبء
58. يساجعت نهبئيت كيًيبء Recommended





كيمياء حديثة أولى ثانوى
أمنية وجدى

كيمياء عامة 1 General chemistry1

طرق تدريس الكيمياء
mohammedalialjabri

الكيمياء والقياس
محمد الجمل

شيماء الحيحي تفاعلات التاكسد والاختزال
Karam Nasralla
-----------------
-----












































57 of 58
مذكرة مميزة فى كيمياء 1ث
1. يساجعت نهبئيت كيًيبء الوحدة األوىل املصطهح انعهًً: املصطلح العلنى العبارة الصيغة اجلشيئية الصيغة األولية املعادلة اللينيائية املعادلة اللينبائية املوسوىة املعادلة األيوىية تفاعل التعادل املواد املتفاعلة املواد الياجتة احلضاب اللينيائى املول عدد أفودادرو 2 3 2 6 ×1 0. 0 عدد املوالت عدد وحدات الصيغة األولية الصيغة اجلشيئية
2. يساجعت نهبئيت كيًيبء املصطلح العلنى العبارة تفاعالت الرتصيب العوامل احلفاسة عهم ملب يأتً:
3. يساجعت نهبئيت كيًيبء 1] حضاب الصيغة األولية [ ]21 = [H = 1 , C انحم:- C H 4CH 2] حضاب الصيغة اجلشيئية [ اىنخيت اىجزيئيت عدد وحداث اىصيغت األوىيت = مخيت اىصيغت األوىيت 2CH انحم1:- 2CH
4. يساجعت نهبئيت كيًيبء 8C4H 2CH 3] حضاب املول[ ]1 = [O = 16 , H انحم1:- ][H2O ]61 = [S = 32 , O )2(SO انحم2:- )2(SO
5. يساجعت نهبئيت كيًيبء ]32 = [Na )3(Na2CO )702 = (Pb [4] احلضاب اللينيائى )2H2(g) + O2(g )2H2O(g ]61 = [H = 1 , O انحم1:- )2H2(g) + O2(g )2H2O(g ][H2O ]61 = [Mg = 24 , O انحم2:- )(Mg )(MgO
6. يساجعت نهبئيت كيًيبء 2Mg + O2 2MgO CaCO3 CaO + CO2 [Ca = 40, C = 12, O = 16] :3انحم (CaCO3) (CaO) CaCO3 CaO + CO2 [Na = 23, Cl = 35.5] (NaCl) -:4انحم NaCl NaCl Na+ + Cl-
7. يساجعت نهبئيت كيًيبء )-(Cl = [Zn ]5.53 = 65, Cl انحم5: )2(ZnCl Zn + 2HCl 2ZnCl2 + H يسبئم عهً انىحدة األوىل ]21 = [H = 1 , C ]61 = [Na = 23, C = 12, O 2CH ]1 = [C = 12, H ]61 = [N = 14, O ]1 = [N = 14, H 2CH ]1 = [C = 12, H
8. يساجعت نهبئيت كيًيبء [Mg = 24, S = 32, O = 16, H = 1] [Zn = 65, S = 32, O = 16, H = 1] 2H2(g) + O2(g) 2H2O(g) [S = 32 , O = 16] (SO2) [Na = 23] (Na2CO3) [Na = 23, C = 12, O =16] (Pb = 207) [Mg = 24, H = 1, Cl = 35.5] CH4 + 2O2 CO2 + 2H2O [C = 12, H = 1, O = 16] 2H2 + O2 2H2O وضح ببملعبدالث انسيصيت املىشونت
9. يساجعت نهبئيت كيًيبء الوحدة الجاىية املفهىو انعهًي : املفهوو العبارة العلنى احمللول احلقيقى املذيب املذاب املعلق الغزوى األمحاض +H القواعد -OH القلويات +H تفاعل التعادل -OH الزابطة اهليدرودييية األمحاض القوية األمحاض الطعيفة امللح Na2CO3.10H2O صودا الغضيل
10. يساجعت نهبئيت كيًيبء املفهوو العبارة العلنى ,4{H2SO األمحاض }HCI املعدىية األمحاض }{CH3COOH العطوية قاعدية احلنض أىَيدريد القاعدة التأيً البيشيً العطزى عنلية التصنب التنيع اللاتيوٌ األىيوٌ اذكس انسبب انعهًً
11. يساجعت نهبئيت كيًيبء CH3COOH (H+) (OH-) NH3 NH4Cl + NaOH NaCl+H2O+NH3
12. يساجعت نهبئيت كيًيبء CO2 + Ca(OH)2 CaCO3 + H2O
13. يساجعت نهبئيت كيًيبء
14. يساجعت نهبئيت كيًيبء املقبزنبث احمللول الغروى احمللول احلقيقى
15. يساجعت نهبئيت كيًيبء تصييف األمحاض 1] تقسيه األمحاض طبقاً لطبيعة ميشأها:- [ أمحاض عضوية أمحاض معدىية املقارىة ميشأها HCl CH3COOH 3HNO أمجلة 6C4H6O 4H2SO 7C6H8O 2] تقسيه األمحاض تبعاً لقوتها:-[ أمحاض ضعيفة أمحاض قوية املقارىة التأيً التوصيل للكهرباء CH3COOH HCl 3HNO أمجلة 3C3H6O 4H2SO
16. يساجعت نهبئيت كيًيبء 3] تقسيه األمحاض تبعاً لعدد قاعديتها:-[ أمحاض ثالثية أمحاض ثيائية أمحاض أحادية املقارىة القاعدية القاعدة القاعدة عدد الربوتوىات )+(H HCl 4H3PO 4H2SO أمجلة CH3COOH 7C6H8O 4H2C2O 3HNO
17. يساجعت نهبئيت كيًيبء اللشف عً بعض الشقوق احلامطية: بتفاعل محض اهليدروكلوريك مع أمالح األمحاض األقل ثباتاً: (الشق احلامضى) املشاهدة التجربة )-23(CO )2(CO )-3(HCO )2(SO )-23(SO )2(SO -2)3(S2O )(S )(NO - )2(NO )2(NO التنييز بني ملح الكربوىات والبيكربوىات: (الشق احلنضى) املشاهدة التجربة )-23(CO )-3(HCO
18. يساجعت نهبئيت كيًيبء مب دور مو مه بىدرة اىخيل فى صىبعت اىصببىن:
19. يساجعت نهبئيت كيًيبء اكًم انعببزاث اآلتيت 3SO )(II
20. يساجعت نهبئيت كيًيبء .dil 4(24) Zn + H2SO ……+ …… .dil 4(25) CuO + H2SO …… + …… .dil )62( Mg + 2HCl …… + …… )72( 3KOH + HNO …… + …… )82( 3ZnCO3 + 2HNO …… + …… )92( 2MgSO4 + BaCl …… + …… )03( 4CuCO3 + H2SO …… + …… )13( NH4Cl + NaOH …… + …… اكتب املعبدالث انىت تدل عهً انتفبعالث اآلتيت اخرت ين بني األقىاض C 2CO
21. يساجعت نهبئيت كيًيبء 4H2C2O 4H3PO 3C6H8O7 C3H6O 3(C3H6O 6C4H6O )CH3COOH 7C6H8O 4H2SO 4H2C2O أكتب املصطهح انعهًً انري تدل عهيه انعببزاث اآلتيت:-
22. يساجعت نهبئيت كيًيبء عهم ملب يأتً: 4H3PO كيف تفسق بني:- وضح ثبنشسى
23. يساجعت نهبئيت كيًيبء الوحدة الجالجة املفهىو انعهًي : املفهوو العبارة العلنى اليظائز امليشوٌ اإلللرتوٌ فولت طاقة الرتابط اليووى اليشاط اإلشعاعى الطبيعى التفاعل اإلىشطارى التفاعل املتضلضل عنز اليصف دضيه ألفا دضيه بيتا التفاعل
24. يساجعت نهبئيت كيًيبء املفهوو العبارة العلنى االىدمادى ىظزية الله لبالىم قاىوٌ بالىم التفاعالت التووية مجمىع أعداد اىبروحىوبث اىمىجبت أو األىنخرووبث اىخى حدور حىه العدد الذرى اىىىاي فى اىحبىت اىعبديت العدد اللتلى الوسٌ الذرى تظزية الدكتور على مشزفة ثابت بالتم وحدة اللتل الذرية الضعز اجلول
25. يساجعت نهبئيت كيًيبء املفهوو العبارة العلنى العيصز املضتقز العيصز املشع اللتلة احلزدة اليشاط األشعاعى الصياعى
26. يساجعت نهبئيت كيًيبء اذكس انسبب انعهًً :
27. يساجعت نهبئيت كيًيبء . (11) 92U 832 1+ 0n 92U 932 + 932 932 92U 93Np 0+ -1e 932 932 93Np 94Pu 0+ -1e
28. يساجعت نهبئيت كيًيبء أهى انسسىيـــــــــبث : T.N.T
29. يساجعت نهبئيت كيًيبء يسبئم
30. يساجعت نهبئيت كيًيبء 91 9F 65 26Fe
31. يساجعت نهبئيت كيًيبء الوحدة الزابعة املصطهح انعهًي املصطلح العبارة العلني اللينياء احلزارية طاقة وضع اإلللرتوٌ طاقة حزكة اإلللرتوٌ اجلشئ طاقة الزابطة التفاعل اللينيائى حملول ربع مولز اجلول 1 81.4 حزارة الذوباٌ صعزال احملتوى احلزارى قاىوٌ ٍط طاقة اإلماٍُ احمللول املوالرى قوى دذب فاىدرفال الشبلة البلورية
32. يساجعت نهبئيت كيًيبء املصطلح العبارة العلني أكضيد ىيرتيم حزارة التخفيف حزارة الذوباٌ حزارة الذوباٌ املوالرية التغري فى احملتوى احلزارى احلالة القياصية املعادلة اللينيائية احلزارية غاس األوسوٌ ثاىى أكضيد الييرتودني طاقة الشبلة البلورية حزارة الرتصيب حزارة التلويً ة احلالة الفيشيائي الرتكيش باملولز طاقة املضتوى Hلتفاعل كينيائى
33. يساجعت نهبئيت كيًيبء املصطلح العبارة العلني تفاعل ماص للحزارة طاقة اإلماٍة طاقة االرتباط عهم ملب يأتً
34. يساجعت نهبئيت كيًيبء H2O H2O -* HI HF HF > HCl > HBr > HI H
35. يساجعت نهبئيت كيًيبء H
36. يساجعت نهبئيت كيًيبء يبذا يقصد بـ 5.53 = H = 1, Cl (6) طبقت اىرابطت فى جزئ اىبروً = 64 ك. سعر/مىه. (7) اىطبقت اىمىطيقت عىد حنىيه مىه مه 2 COمه عىبصري األوىيت فى حبىخهب اىقيبسيت 393 ك.ج 2CO (8) طبقت اىشبنت اىبيىريت فى ميح اىطعبً = 5.12 ك. جىه / مىه NaCl
37. يساجعت نهبئيت كيًيبء يقبزنبث H H
38. يساجعت نهبئيت كيًيبء التحويل مً دول إىل صعز انطبقخ ثبنجىل انطبقخ ثبنسعش 81.4 = التحويل مً صعز إىل دول انطبقخ ثبنجىل = انطبقخ ثبنسعش × 81.4 الرتكيش املوالرى عذد انًىالد يٍ انًبدح انًزاثخ انزشكيض انًىالسي انحجى ثبنهزش = وصٌ انًزاة ثبنجشاو انزشكيض = انكزهخ انجضيئيخ انجشاييخ نهًزاة × حجى انًحهىل ثبنهزش وصٌ انًبدح ثبنجشاو عذد انًىالد = انكزهخ انجضيئيخ انجشاييخ التغري فى احملتوى احلزارى H =H انًجًىع انججشي نطبقخ ركىيٍ انشواثط وطبقخ كسش انشواثط كنية احلزارة كًيخ انحشاسح = كزهخ انًبدح × حشاسرهب انُىعيخ × فشق دسجبد انحشاسح حشاسح انزوثبٌ = انًجًىع انججشي نطبقخ اإليبهه وطبقخ انشجكخ انجهىسيخ حشاسح انزخفيف = رغيش انحشاسي نهًحهىل انثبًَ – انزغيش انحشاسي نهًحهىل األول ال التغري فى احملتوى احلزارى H انزغيش انحشاسي =H حشاسح ركىيٍ انُىارج – حشاسح ركىيٍ انًزفبعالد
39. يساجعت نهبئيت كيًيبء مسائل ]61 = [H = 1, S = 32, O 4H2SO وصٌ انًزاة ثبنجشاو انكزهخ انجضيئيخ انجشاييخ نهًزاة × حجى انزشكيض = انًحهىل ثبنهزش H 2N2 + 3H 32NH .N N = 946 K. J., N – H = 390 K. J., H – H = 435 K.J اىحو H | N N + 3H – H 2 N–H | H طبقخ كسش انشاثطخ طبقخ ركىيٍ انشاثطخ H H 2CI2 + 2H2O 24HCl + O
40. يساجعت نهبئيت كيًيبء H – Cl = 432 KJ, Cl – Cl = 242 KJ, O = O = 497 KJ, O – H = 463 KJ Cl Cl CH4 + Cl2 CH3Cl + HCl, Δ H = - 25 K.cal H - Cl CH3 - Cl CH3 - H 2C2H6 + 7O2 4CO2 + 6H2O, H = - 2400 K.J. – :اىحو حشاسح ركىيٍ انًزفبعالد حشاسح ركىيٍ انُىارج – – H – CH4 (g) + 2O2(g) CO2 (g) + 2H2O(v) :اىحو – H
41. يساجعت نهبئيت كيًيبء حشاسح ركىيٍ انًزفبعالد حشاسح ركىيٍ انُىارج – H Al2Cl6 + 6 Na .2Al + 6 NaCl, H = - 1074.6 K.J اىحو Al2Cl6 + 6 Na .2Al + 6 NaCl, H = - 1074.6 K.J حشاسح ركىيٍ انًزفبعالد حشاسح ركىيٍ انُىارج – H – ]1 = [S = 32, O = 16, H اىحو ]4[H2SO
42. يساجعت نهبئيت كيًيبء ]32 = [H = 1, O = 16, Na اىحو:- ][NaOH )(KOH )93 = (H = 1, O = 16, K )Ag+NO3-(aq) + Na+Cl-(aq )Na+NO3-(aq) + AgCl(s H = -35.6 kJ/mol (أ) رشسيت 1.0 يىل يٍ كهىسيذ انفضخ. (ة) رشسيت 53.41 جى يٍ كهىسيذ انفضخ. إرا عهًذ أٌ انكزم انزسيخ كبآلرً: }801 = {Cl = 35.5, Ag اىحو ][AgCl
43. يساجعت نهبئيت كيًيبء اىحو:- HCl اىحو:- يسبئم غري حمهىنت
44. يساجعت نهبئيت كيًيبء C + O2 CO2, H = - 393.3 KJ CO + ½ O2 CO2, H = - 283.7 KJ N2O2, NO, NO2 N2 + 3H2 2NH3, Δ H = - 89 K.J. H H N H ΔH H2 + Br2 2HBr H H Br Br H - Br [H2SO4] [H = 1, S = 32, O = 16] Cl Cl CH4 + Cl2 CH3Cl + HCl, Δ H = - 25 K.cal CH3 - H CH3 - Cl H - Cl N2 + O2 2NO, Δ H = + 180 K.J.
45. يساجعت نهبئيت كيًيبء C + O2 CO2, Δ H = - 393.5 K.J. 1 N2 + 3 H2 NH3, H = - 46.19 K J 2 2 2C + 2H2 C2H4, H = +52.3 K.J. [Na = 23, H = 1, O = 16] [Na = 23, H = 1, O = 16] C3H8 C3H8 + 5 O2 3CO2 + 4H2O Δ H - 2228.5 K.J. 2C2H6 + 7O2 4CO2 + 6H2O Δ H - 2400 K.J.
46. يساجعت نهبئيت كيًيبء 22H2 + O .2H2O Δ H - 570 K.J 2C2H2 + 5/2 O 2CO2 + H2O
47. يساجعت نهبئيت كيًيبء الوحدة اخلامضة املصطهح انعهًً املصطلح العلني العبارة التخنز الالٍوائى (البيوداس) (امليجاٌ) ( غاس املضتيقعات) اهليدروكزبوىات البلنزة التقطري التذشيئى إعادة الدورة تلوخ البيئة الغاس املائي أثز البيت األخطز (الصوبات الشدادية) التلضري رابع إيجيل الزصاص أللاىات غاس اإليجيلني التقطري اإلتالفى غاس البوتاداس األللييات
48. يساجعت نهبئيت كيًيبء املصطلح العلني العبارة األللاييات البولينز احرتاق الوقود رقه األوكتاٌ رقه األوكتاٌ التيقية البيشوبرييً أكضيد ىيرتيم الوقود حزارة الذوباٌ غاس األوسوٌ ثاىى أكضيد الييرتودني 2CO طاقة املضتوى أول أكضيد اللزبوٌ الفزض العطوى الفصل التحويل التخنز اللحوىل إىشيه اإلىفزتاس
49. يساجعت نهبئيت كيًيبء املصطلح العلني العبارة إىشيه الشمياس 2CO امللوثات محض اخلليلم عهم ملب يأتً 2H2 + Cl 2HCl + heat, light 43 - 2CO
50. يساجعت نهبئيت كيًيبء
51. يساجعت نهبئيت كيًيبء
52. يساجعت نهبئيت كيًيبء أسئهت يتنىعت أضزار مزكبات الزصاص. ( 1) (2) مادة البيشوبرييً. (3) غاس أول أكضيد اللزبوٌ: (4) أثز البيت األخطز لغاس ثاىى أكضيد اللزبوٌ: 2CO 2CO
53. يساجعت نهبئيت كيًيبء املقبزنبث . . )02(C )21(C ) ( )01(C5:C
54. يساجعت نهبئيت كيًيبء وضح اندوز انري يقىو به كم ين: 1] البلرتيا فى صياعة البيوداس: [ 2] رابع أيجيل الزصاص 4)5 Pb(C2Hعيد إضافتُ للذاسولني: [ 3] أىشيه األىفزتاس أثياء التخنز اللحوىل:[ 4] األصطح الشدادية وتلويً غاس ثالح أكضيد اللربيت: [ 5] أكضيد امليذييش أو أكضيد األلومييوو أو الطفل فى التلضري احلفشى:[ 6] أىشيه الشمياس أثياء التخنز اللحوىل:[ يب املقصىد بكم ين: 1] رقه أوكتاٌ لوقود 9 0 [ 2] غاس البوتاداس: [ 3] الفزض العطوى ليشأة البرتول:[ انذالئم عهً صحخ انفشض انعضىي:
55. يساجعت نهبئيت كيًيبء وضح ببملعبدالث انسيصيت انفرتاز 4C2H5OHزيماز C12H22O11 + H2O 6C6H12O6 + C6H12O 2+ 4CO C2H5OH CH3COOH + H2O 2H2 + Cl 2HCl + heat, light Heat 2S + O 2SO Cat./ H 22SO2 + O 32SO SO3 + H2O 4H2SO أضرار أمبسيد اىنبريج: أضرار األمطبر اىحبمضيت ىحمض اىنبريخيل 3CaCO 4CaSO cat./H CH4 + H2O 2CO + 3H
56. يساجعت نهبئيت كيًيبء cat./H 2CO + 2H CH3OH 2NO2 + H2O 2HNO3 + HNO أضشاس أكبسيذ انُيزشوجيٍ: 22NO + O 22NO
57. يساجعت نهبئيت كيًيبء
58. يساجعت نهبئيت كيًيبء Recommended





كيمياء حديثة أولى ثانوى
أمنية وجدى

كيمياء عامة 1 General chemistry1

طرق تدريس الكيمياء
mohammedalialjabri

الكيمياء والقياس
محمد الجمل

شيماء الحيحي تفاعلات التاكسد والاختزال
Karam Nasralla
-----------------
ليست هناك تعليقات:
إرسال تعليق